碳同位素的自然平衡
原子有質子、中子和電子構成。由于元素的類型是由質子的數量決定的,所以同一元素的不同原子之間可以存在不同的種類,這些種類被稱為同位素。例如,碳有6個質子,原子的平均重量是12.0107。就平均而言,核中還有6個中子。也可能含有更多的中子,例如7或8個。核心中有7個中子的同位素仍然是穩定的,但是有8個中子的碳原子就具有放射性,會發生衰變。這個原子的重量為14 (8個中子+ 6個質子),因此被稱為 14C (C-14)。這14C的半衰期為5700 (+- 30)年,意味著50%的14C將在大約5.700年內衰變為氮(14N)。
因為14C是一種不穩定的同位素,所以在自然界中不會大量的存在。然而,在9至15公里高度的大氣中,宇宙輻射與現有的氮原子相互作用,將14N持續轉變為14C。再加上14c持續衰變回到14N,這樣就會導致14C濃度與穩定12C濃度之間的自然平衡。每萬億12C原子大約有一個14C原子。
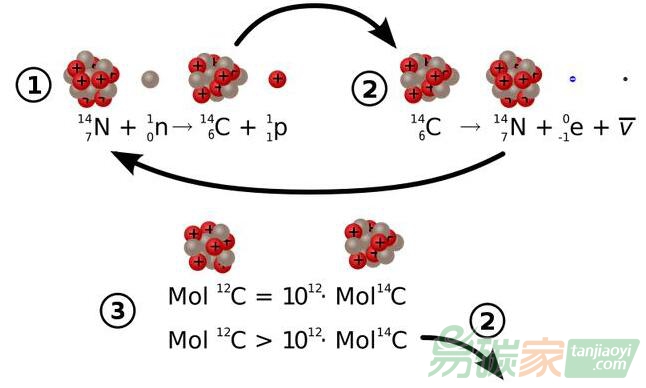
?碳14衰變和生成的物理學:①表示14N和宇宙輻射產生14C, ②表示14C的放射性衰變,③表示不同同位素的近似濃度。
從這種平衡中得出年齡
與碳14的衰變速率相比,大氣中的氣體粒子反應得速度相對較快。因此,如果一個重量為14的碳原子與一個氧原子反應生成二氧化碳,然后被一個有機體吸收,那么我們就可以假設這個有機體體內的14C和12C的平衡與大氣中的一樣。在有機體的整個生命周期中,它們都在與環境交換碳,其平衡就幾乎等同于大氣的平衡。
當有機體死亡時,它就停止與環境交換碳原子。只有14C的衰變還在繼續發生。假設你在地下深處發現了一塊未知年代的木頭。你可以測量碳14原子的放射性輻射。如果你發現這種輻射只有大氣中14C濃度的一半,那么你就可以推斷這塊木頭已經有5.700年的歷史了。請注意,你測量的年齡是有機體停止與環境交換碳的年齡!所以這也是有機體死亡的時間。